FORPRION
BAYERISCHER FORSCHUNGSVERBUND PRIONEN

LMU 10 Pathophysiologische Rolle des Prionproteins an hippocampalen exzitatorischen Synapsen
Arbeitsfeld:
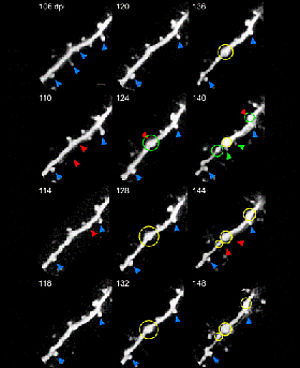
Grundlagen der PrionkrankheitenZiel: Identifizierung von grundlegenden Mechanismen synaptischer Dysfunktion als mögliche Ursache für den Untergang von Nervenzellen bei Prionerkrankungen. Experimentelles Vorgehen und Hintergründe: 1. Analyse der neuronalen Kalziumhomöostase und kalziumabhängiger Ionenströme über die Zellmembran in akuten vitalen Hirnschnittpräparten der Prnp-/- Maus. Die Kalziumhomöostase wurde deshalb im Detail untersucht, weil unsere vorherigen Studien an der Prnp-/- Maus gezeigt hatten, dass die von uns und anderen beobachtete Störung der exzitatorischen synaptischen Übertragung durch den Verlust des Prionproteins kalziumabhängig ist. 2. Untersuchung der funktionellen Bedeutung der kupferbindenden N-terminalen Domäne des Prionproteins bei oxidativem Stress: a) Untersuchung von immortalisierten Zellen aus Prnp-/-Gehirnen, die unterschiedliche N-terminale Mutanten des Prionproteins exprimieren und vergleichende Analyse von primären Körnerzellen aus dem Kleinhirn von transgenen Mäusen, die N-terminal deletiertes Prionprotein exprimieren im Vergleich zu solchen, die normales oder kein Prionprotein exprimieren. Vorstudien des Antragstellers hatten gezeigt, dass der Verlust des N-terminus von PrP eine Störung der Modulation der synaptischen Übertragung unter oxidativem Stress bedingt. 3. Untersuchung der Kinetik des Untergangs exzitatorischer Synapsen im Verlauf der Prionerkrankung. Zur Klärung der Frage ob eine Schädigung der Funktion von synaptischen Endigungen dem Nervenzelltod vorausgeht, wurden dendritische Spines, also die Postsynapse erregender Synapsen, im Krankheitsverlauf morphologisch qualitativ und quantitativ untersucht. Da der Umbau dendritischer Spines ein sehr plastischer Vorgang ist, haben wir eine neue Methode am ZNP etabliert mit der diese kleinen Strukturen in der Hirnrinde der Maus am lebenden scrapie infizierten Tier untersucht werden können – die in vivo Zweiphotonenmikroskopie. Ergebnisse und Diskussion: I) Unsere Studie zeigt, dass der Verlust des Prionproteins die Kalziumhomöostase in Nervenzellen verändert und dass diese Störungen kalziumabhängiger zellulärer Mechanismen wie den Kaliuminflux über kalziumsensitive Kaliumkanäle nach sich zieht (Korte et al. 2003, Fuhrmann et al. 2006). Als Ursache für die gestörte zytosolische Kalziumkonzentration konnte ein verminderter Kalziumeinstrom über spannungsaktivierte Kalziumkanäle vom L-Typ identifiziert werden (Fuhrmann et al. 2006). Dieser ist sehr wahrscheinlich bedingt durch eine verminderte Dichte funktioneller L-typ Kanäle an der Plasmamembran. IIa) Untersuchung immortalisierter neuronaler Zellen aus dem Gehirn von Prnp-/- Mäusen und von Prnp-/- Gehirnlysaten: Wir haben in biochemischen Untersuchungen zeigen können, dass ein funktioneller Zusammenhang zwischen der Expression des Prionproteins und der Aktivierung der Phosphatidylinositol 3-Kinase (PI3-Kinase) besteht. Dieses Protein spielt eine zentrale Rolle für das Überleben von Zellen unter oxidativem Stress. Weiter gelang es uns zu zeigen, dass die N-terminale kupferbindende Oktapeptidregion bzw. die kupferbindenden Histidine in diesem Bereich des Prionproteins für diese Modulation der Aktivität der PI3- Kinase verantwortlich ist. (Vassallo et al. 2005). Da bekannt ist, dass die PI3-Kinase über eine Modulation der Expression der beta2 Untereinheit von VGCCs die Funktion von spannungsaktivierten Kalziumkanälen regelt, ist es sehr wahrscheinlich, dass der von uns beobachtete verminderte Kalziuminflux über diesen Kanal (siehe Punkt I.) Folge der verminderten PI3-Kinase Aktivität ist. IIb) Untersuchungen an kultivierten Körnerzellen aus dem Kleinhirn von transgenen Mäusen mit einer N-terminalen Deletion im Prionprotein-Gen zeigen, dass die Kupferbindung an PrP und die damit in Zusammenhang stehende Modulation der zellulären Kalziumhomöostase eine wichtige Rolle in der zellulären Signalkaskade bei oxidativem Stress spielt, an der die Kinasen Fyn und PI3-Kinase beteiligt sind (Krebs et al. 2007). III) In vivo Untersuchung exzitatorischer Synapsen im Gehirn scrapie infizierter Mäuse: Zweiphotonenmikroskopische Untersuchung des Untergangs dendritischer Spines in der Hirnrinde über bis zu 2 Monate. Schon vor dem auftreten erster Sympotome haben wir einen Untergang synaptischer Spines beobachtet. Interessanter Weise beobachteten wir, dass nur sogenannte persistierende Spines (Spines die mehr als 8 Tage stabil sind) degenerieren während sogenannte transiente Spines (Spines die innerhalb von 4 Tagen nach ihrer Entstehung wieder verschwinden) über den gestammten Verlauf der Scrapieerkrankung nicht vermindert auftreten oder schneller wieder absterben. Spineuntergänge wurden des Weiteren insbesondere an solchen Abschnitten der Dendriten beobachtet, die Auftreibungen, sogenannte Varikositäten, ausgebildet hatten. Dieser Befund legt die Vermutung nahe, dass diese dendritischen Auftreibungen ursächlich sind für den Untergang dendritischer Spines im Scrapie Mausmodell. (Fuhrmann et al. revised submission J. Neurosci).